Soluzioni ambientali per ridurre lo stress da calore
Giugno 24, 2024
Lo stress da caldo nei bovini da carne
Luglio 19, 2024SINDROME DELL’INTESTINO PERMEABILE O LGS
Una sfida da vincere per il benessere, la salute e la produttività di vacche e vitelli.
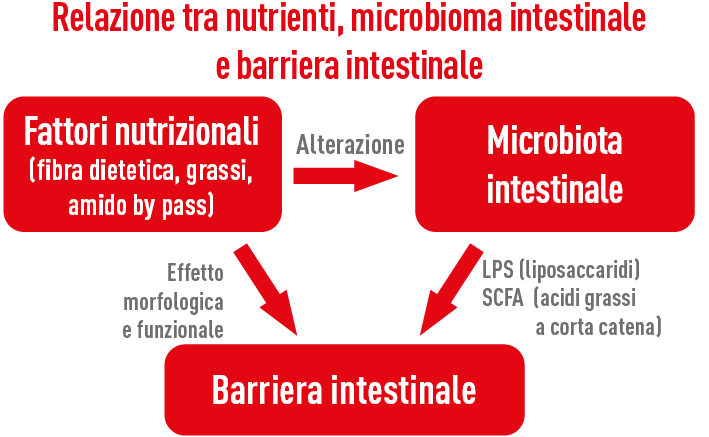
La sindrome dell’intestino permeabile o LGS si può definire in senso generale come l’incapacità della barriera intestinale di fungere da membrana semipermeabile in grado cioè di assorbire i nutrienti necessari e impedire alle sostanze indesiderate (batteri, LPS, antigeni alimentari, etc.) di entrare nel flusso sanguigno e nell’organismo.
In presenza di intestino permeabile la possibilità di penetrazione di sostanze indesiderate oltre la barriera intestinale per alterazione delle giunzioni serrate (Tigth Junctions) stimola una risposta immunitaria e questa evenienza si verifica con maggior probabilità nella fase di svezzamento del vitello e nel periodo di transizione della vacca.
Quali cause portano alla LGS?
Diverse situazioni possono portare a un aumento della permeabilità intestinale, tramite meccanismi differenti, ma sostanzialmente tutte determinano un’attivazione immunitaria, che comporta costantemente un aumento della risposta infiammatoria, innescata prevalentemente dalla liberazione di LPS (Lipo-PoliSaccaridi contenuti nelle membrane cellulari dei batteri Gram negativi). Tra i vari fattori predisponenti alla Leaky Gut Syndrome annoveriamo lo stress termico (soprattutto da caldo ma anche da freddo estremo), lo stress del periodo di transizione, gli stati di acidosi ruminale e intestinale, la ridotta ingestione di alimento, i vari stress ambientali (spostamenti, trasporti, sovraffollamento, cambi dieta, svezzamento, patogeni, muffe e tossine, trattamenti antibiotici, etc.).
Stress da caldo e LGS
Durante lo stress da caldo il flusso sanguigno viene indirizzato dai visceri verso i tessuti periferici nel tentativo di dissipare calore e questo comporta ipossia e deficit di nutrienti a livello intestinale, a cui sono particolarmente sensibili gli enterociti. Ciò produce stress ossidativo (Hall et al.,2001) e riduzione della produzione di ATP, e si traduce nell’alterazione funzionale e morfologica delle Tight Junction (Pearce et al.,2013).
Tutto questo determina un aumento della permeabilità della barriera intestinale, consentendo il passaggio dal contenuto del lume intestinale al circolo ematico portale e sistemico di LPS, endotossine ad alto potere immunoattivatore e in grado di stimolare direttamente o via GLP-1 la secrezione di insulina (Kahles et al.,2014), prima ancora di innescare la cascata infiammatoria, generando così un quadro metabolico di iperinsulinemia (Baumgard et Rhoads,2013).
Tale situazione genera un grave deficit energetico metabolico (basti pensare che l’attivazione del sistema immunitario consuma circa 1 Kg di glucosio ogni 12 ore), con gravi ripercussioni produttive e sanitarie.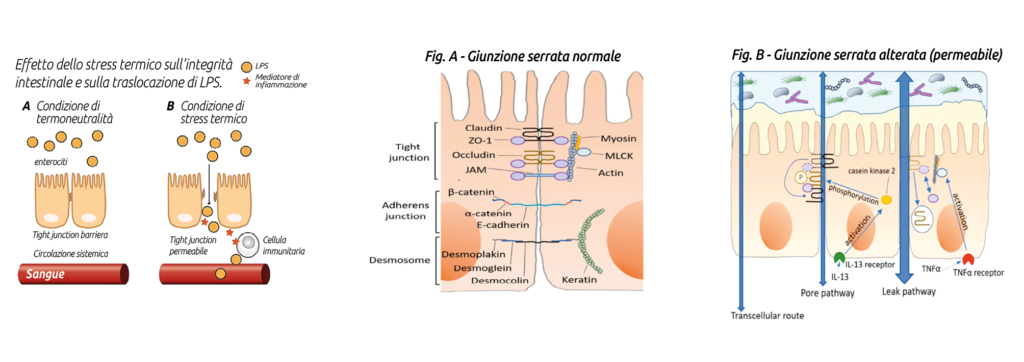 Periodo di transizione e LGS
Periodo di transizione e LGS
Nel periodo di transizione un aumento della permeabilità intestinale, oltre ad una presenza di endotossine eventualmente di origine uterina o mammaria (Mani et al., 2012), può derivare anche da condizioni di acidosi ruminale o ridotta ingestione alimentare o altri stress psicologici da spostamento/ competizione. E in ogni caso un moderato stato infiammatorio è fisiologicamente connaturato all’evento parto.
Lo stato infiammatorio che accompagna il parto nella vacca di fatto rimodula la fisiologica ripartizione dei nutrienti andando a compromettere la normale produttività (Bertoni et al.,2008), come riconfermato da sperimentazioni con infusione di TNFα che facevano rilevare riduzione di produzione, con aumento di TAG senza aumento di NEFA. E infatti, in vacche chetosiche senza altre patologie peripartali (né metrite, né mastite) si rileva normalmente un aumento dei markers infiammatori quali LBP (liposaccarid binding protein), siero amiloide A e aptoglobina (Abuajamieh et al.,2016).
È da ricordare, comunque, che un moderato stato infiammatorio risulta “fisiologico” al parto e necessariamente utile al regolare processo evolutivo post parto e solo l’infiammazione persistente ed eccessiva va evitata (Trevisi et Minuti., 2018). Per cui, l’obiettivo in tale fase dev’essere quello di regolare il processo infiammatorio “fisiologico” evitando di sopprimerlo, cosa che potrebbe portare a peggioramenti dello stato di salute delle vacche.
Acidosi ruminale e/o intestinale e LGS
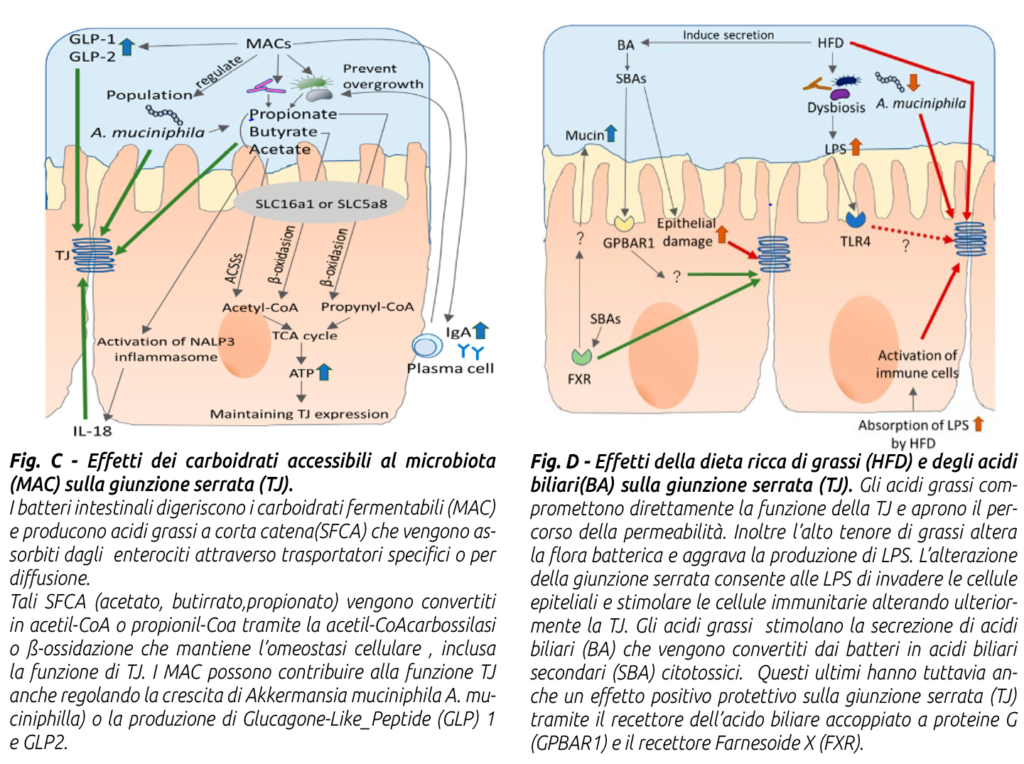
Il danno a livello dell’epitelio della parete ruminale e della mucosa intestinale che si verifica in corso di acidosi è alla base dei meccanismi che portano alla LGS in tali situazioni. La condizione che produce l’acidosi deriva da un accumulo di AGV rispetto alle capacità di assorbimento locale a livello ruminale o intestinale, conseguente a un improvviso aumento di substrati amilacei da fermentare; tale situazione consegue a un repentino cambio di dieta come avviene nel vitello in fase di svezzamento o nella vacca al parto o qualora ci sia un eccesso di by-pass amilaceo a livello intestinale.
Quest’ultimo evento si verifica in concomitanza di eccessivi apporti quantitativi di amido o di amido poco degradabile a livello ruminale o ancora per alterazioni del transito che superano la capacità di digestione amilasica pancreatica (che nella vacca probabilmente si attesta al massimo a 1 kg di amido by-pass) portando a fermentazioni in sede di intestino crasso con conseguente acidosi locale e possibilità di traslocazione di LPS dal lume intestinale al circolo ematico, provocando così l’insorgenza di LGS e le correlate conseguenze (Li et al., 2012; Minuti et al., 2014).
Ridotta ingestione di alimento e LGS
Tutte le condizioni che comportano una restrizione dell’ingestione alimentare (stress termico, svezzamento, competizione per spostamenti o sovraffollamento, trasporti) determinano uno stress che produce iperpermeabilità intestinale (Chenet al., 2015). Una recente prova con vacche alimentate al 40% rispetto a vacche alimentate ad libitum ha mostrato un riduzione a livello dell’ileo della lunghezza dei villi e della profondità delle cripte (Kvidera et al., 2017).
I recenti studi al riguardo indicano che in caso di restrizione alimentare il CRF (fattore di rilascio della corticotropina) possa essere il meccanismo d’azione che porta alla LGS (Wallon et al., 2008; Vanuytsel et al., 2014). Infatti, il CRF e altri fattori simili come l’Urocortin 1, 2 e 3 e i recettori di coppia delle loro proteine G, il CRF 1 e il CRF 2, in seguito a restrizione alimentare, sono stati identificati come i principali mediatori dello stress a livello intestinale determinando infiammazione, alterata motilità e permeabilità e anche inversione tra secrezione e assorbimento di ioni, acqua e muco (Rodiño-Janeiro et al., 2015).
Questa alterazione pare in gran parte regolata dalle mast-cells (mastociti) dell’intestino (Santos et al.,2000); queste cellule sono importanti mediatori sia del sistema immunitario innato che adattativo ed esprimono recettori CRF1 e CRF2 che possono in parte spiegare l’associazione tra stress e iperpermeabilità intestinale (Smith et al., 2010; Ayyadurai et al., 2017).
Inoltre, le mast-cells sintetizzano diversi mediatori pro infiammatori (quali IFN-γ e TNF-α) che vengono rilasciati in corso di attivazione e principalmente in fase di degranulazione (Punder et Pruimboom, 2015). Una degranulazione eccessiva dei mastociti gioca un importante ruolo nella patogenesi di molti disordini intestinali (Santos et al., 2000).
Conseguenze fisiopatologiche dell’intestino permeabile
La traslocazione delle LPS conseguenti all’aumento della permeabilità intestinale in corso di LGS comportano l’attivazione delle cellule immunitarie e conseguente infiammazione, il cui alto costo energetico fa reindirizzare i nutrienti altrove rispetto al normale processo anabolico per la sintesi di latte e muscolo, e ciò compromette la produttività!
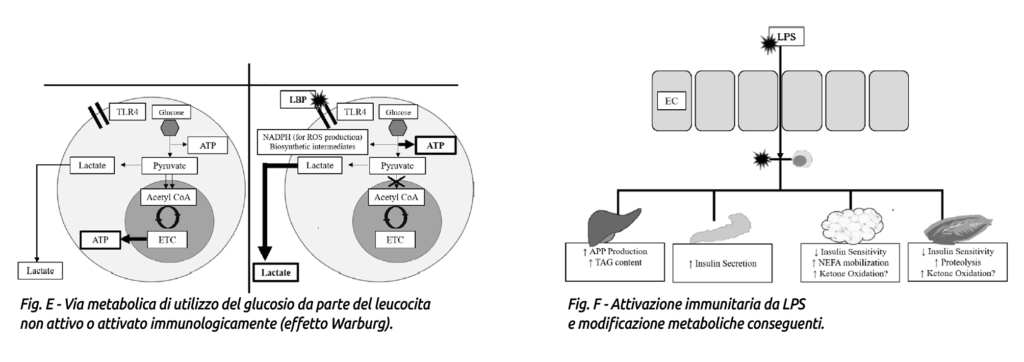
Le cellule immunitarie attivate iniziano ad utilizzare il glucosio attraverso la via glicolitica aerobica invece che utilizzare la fosforilazione ossidativa, processo noto col nome di effetto Warburg (Fig. E). Il cambio metabolico di utilizzo del glucosio da parte delle cellule immunitarie consente una rapida produzione di ATP e la sintesi di intermedi metabolici che supportano la proliferazione cellulare e la produzione di ROS (specie reattive dell’ossigeno) (Calder et al., 2007; Palsson-Mc- Dermott and O’Neill, 2013).
Nel tentativo di facilitare la captazione di glucosio le cellule immunitarie diventano più sensibili all’insulina e aumentano l’espressione di trasportatori GLUT3 e GLUT4 (Maratou et al., 2007; O’Boyle et al., 2012), mentre i tessuti periferici diventano insulino-resistenti (Poggi et al., 2007; Liang et al., 2013).
Inoltre, l’adattamento metabolico alla LGS, comportando iperglicemia o ipoglicemia (in base allo stadio e gravità dello stimolo da LPS), aumenta il livello di insulina o glucagone, il metabolismo aminoacidico muscolare e le conseguenti perdite di azoto (Wannemacher et al., 1980). Si verifica anche uno stato di ipertrigliceridemia (Filkins, 1978; Wannemacher et al., 1980; Lanza-Jacoby et al., 1998; McGuinness, 2005).
Risulta tuttavia interessante come, a dispetto dell’ipertrigliceridemia presente, spesso diminuiscono i livelli ematici di beta-idrossibutirrato in seguito alla somministrazione di LPS (Waldron et al., 2003 a, b; Graugnard et al., 2013; Kvidera et al., 2017a). Il meccanismo che porta alla riduzione del beta-idrossibutirrato indotto dalle LPS non è stato ancor completamente compreso ma potrebbe essere spiegato da un aumento dell’ossidazione dei corpi chetonici da parte dei tessuti periferici (Zarrin et al., 2014). Vedi Fig. F.
Tutti questi adattamenti metabolici in seguito all’attivazione immunitaria da LPS nel loro complesso sono presumibilmente messi in atto per assicurare un’adeguata disponibilità di glucosio ai leucociti attivati.
Come limitare l’insorgenza della LGS?
Le strategie per contenere l’insorgenza dell’intestino permeabile (Leaky Gut Syndrome) devono mirare contemporaneamente a:
1) ridurre la produzione di LPS (LipoPoliSaccaridi)
2) limitare il danno morfologico e funzionale delle giunzioni serrate (Tight Junction). Per cercare di ridurre la produzione di LPS occorre limitare le condizioni che possono determinare disbiosi del microbiota intestinale e favorevoli allo sviluppo di batteri Gram negativi la cui lisi determina liberazione di LPS; ciò si ottiene grazie all’impiego di diete equilibrate con:
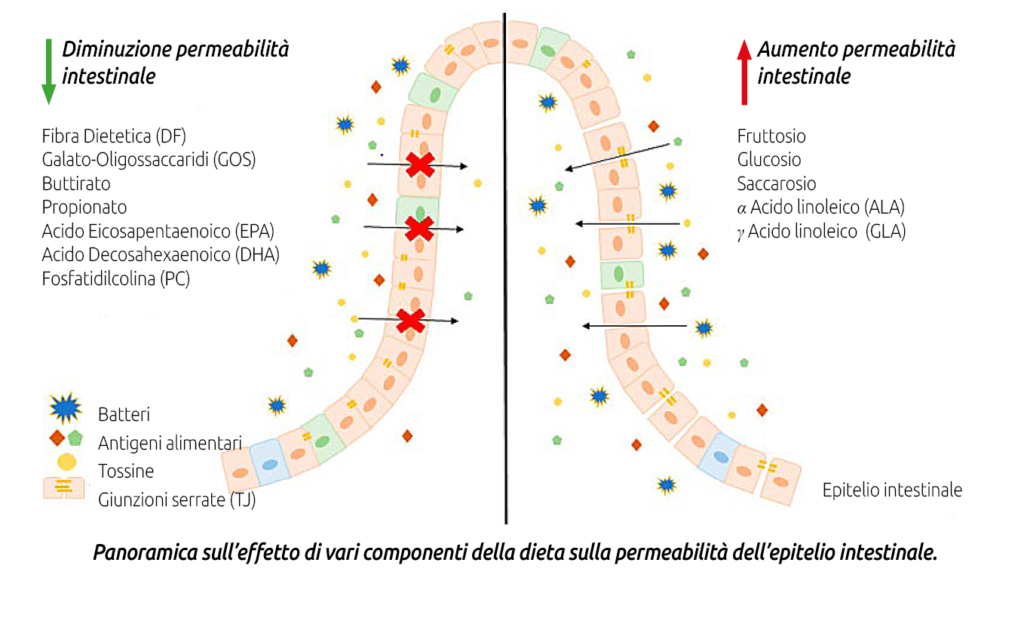
a) corretto apporto di fibra in quantità e qualità;
b) apporto non eccessivo di carboidrati fermentescibili a livello intestinale, soprattutto di amido by-pass;
c) contenere l’apporto di acidi grassi liberi (grassatura da olii o semi integrali ricchi di lipidi, soprattutto se macinati finemente o estrusi) a livello ruminale e intestinale (ad esempio, un acido grasso essenziale come l’acido linoleico Ω6 in quantità eccessiva e non in equilibrio con l’acido linolenico Ω3 esplica un’azione disbiotica sul microbiota intestinale e pro infiammatoria);
d) supplementare additivi ad azione nutraceutica regolatori del microbiota rumino-intestinale quali lieviti vivi, mannano-oligosaccaridi, acidi organici by-pass (Agecon Tecnozoo®). Sull’altro fronte possiamo contenere il rischio di Leaky Gut Syndrome limitando il danno morfo-funzionale alle giunzioni serrate (Tight Junction) assicurando:
a) le condizioni per avere la massima ingestione di alimento;
b) di evitare situazioni di stress termico;
c) di evitare stati di acidosi ruminale e intestinale;
d) di evitare il più possibile situazioni di stress in senso generale (spostamenti, manipolazioni, etc.);
e) l’apporto di fattori dietetici epitelio protettivi in particolare zinco protetto (in forma chelata o proteinato) e vitamina A ed E.
CONCLUDENDO, possiamo senz’altro affermare che ridurre ed evitare la “sindrome dell’intestino permeabile o LGS”
non solo è possibile ma sicuramente necessario se vogliamo assicurare alle nostre vacche il massimo benessere e salute possibile e a noi la loro piena produttività e redditività.
AGECON RBT
Mangime minerale complementare per vacche da latte
- Con lisato di lievito di birra che aumenta la digeribilità della razione;
- Ottimizza la qualità degli alimenti aumentandone le rese;
- Acido formico e propionico assorbiti.
Fonte: Ex Dairy Press, Articolo del Dott. Pierantonio Boldrin MEDICO VETERINARIO, RESPONSABILE SERVIZIO TECNICO TECNOZOO.
Per maggiori info contattare 049 9350 700 o scrivere una mail a tecnozoo@tecnozoo.it
Per rimanere aggiornati su tutte le nostre novità seguici su Instagram o su Facebook.